راهنمای ساخت بافرهای رایج در آزمایشگاه (PBS، Tris، Acetate) + روش دقیق تنظیم pH
در فرآیندهای تحقیقاتی و آموزشی مرتبط با علوم پایه و زیستی، یکی از اصلیترین دغدغهها، حفظ ثبات شرایط فیزیکوشیمیایی محیط واکنش است. در میان این شرایط، کنترل pH، یکی از حیاتیترین فاکتورها محسوب میشود. واکنشهای زیستی نظیر فعالیت آنزیمها، واکنشهای تجزیهای، پایدارسازی ساختار پروتئینها، فرآیندهای استخراج DNA و RNA، همگی به شدت تحت تأثیر pH محیط قرار دارند. کوچکترین نوسان در مقدار یونهای هیدروژن یا هیدروکسید در یک محیط میتواند منجر به توقف کامل واکنش، تغییر ساختار پروتئین، یا افت کیفیت نتایج تحقیقاتی شود. برای جلوگیری از چنین اختلالاتی، محلولهایی تحت عنوان محلولهای بافری (Buffer Solutions) طراحی شدهاند. این محلولها قادرند pH محیط را در برابر تغییرات اسیدی یا بازی، در یک بازه نسبتاً پایدار حفظ کنند. هدف این مقاله، ارائهی یک راهنمای جامع و کاربردی برای درک بهتر عملکرد محلولهای بافری، اصول طراحی، نحوه انتخاب ترکیبات مناسب، روش ساخت، و نکات عملی مهم در تهیه آنها در محیط آزمایشگاهی است. در کنار مباحث نظری، سه بافر پرکاربرد آزمایشگاهی شامل PBS، Tris-HCl و بافر استات بهصورت گامبهگام آموزش داده خواهند شد.
فهرست عناوین
- راهنمای ساخت بافرهای رایج در آزمایشگاه (PBS، Tris، Acetate) + روش دقیق تنظیم pH
مفهوم بافر
محلول بافری، ترکیبی از یک اسید ضعیف و باز مزدوج آن یا بالعکس، باز ضعیف و اسید مزدوج آن است. این ترکیب توانایی فوقالعادهای در مقابله با تغییرات pH دارد. به بیان سادهتر، وقتی یک اسید یا باز قوی به چنین محلولی افزوده میشود، ترکیبات بافر وارد واکنش شده و یونهای H⁺ یا OH⁻ را خنثی میکنند؛ بهطوری که میزان این یونها در محلول به شکل قابلتوجهی ثابت باقی میماند. این واکنشها از قانون تعادل شیمیایی پیروی میکنند و بههمین دلیل، تا زمانی که ظرفیت بافری اشباع نشده باشد، pH محلول بهسختی دستخوش تغییر میشود. برای مثال، بافر اسید استیک – استات، در برابر اضافه شدن HCl یا NaOH مقاومت میکند؛ زیرا یکی از اجزا، نقش دریافتکننده یا دهنده یون را ایفا میکند.
اهمیت pKa و معادله هندرسون–هاسلبالچ
برای طراحی دقیق یک بافر، یکی از پارامترهای مهم، pKa ترکیب اسیدی است. این مقدار که بیانگر قدرت نسبی اسید در محلول آبی است، مشخص میکند که بافر مورد نظر در کدام بازه pH میتواند بیشترین کارایی را داشته باشد. برای محاسبه pH با استفاده از ترکیب اسید و باز مزدوج، از معادله هندرسون–هاسلبالچ استفاده میشود:
(باز مزدوج/ اسید ضعیف)pH = pKa + log
زمانی که pKa ترکیب مورد نظر با pH دلخواه یکسان باشد، نسبت باز به اسید برابر ۱ خواهد بود و بافر در بهترین وضعیت خود قرار دارد. هرچه فاصله pKa از pH هدف بیشتر شود، عملکرد بافر نیز ضعیفتر خواهد بود.
انتخاب صحیح بافر
انتخاب یک محلول بافری مناسب برای انجام یک واکنش شیمیایی یا زیستی، فرآیندی است که باید با در نظر گرفتن مجموعهای از عوامل علمی و عملی صورت گیرد. نخستین و شاید مهمترین فاکتور در این انتخاب، محدودهی pH مورد نیاز برای انجام واکنش است. یک بافر مناسب باید بتواند در بازهی pH هدف، بهخوبی pH محیط را تثبیت کرده و از نوسانات آن جلوگیری کند.
عامل دوم، حساسیت واکنش یا ترکیبات موجود به یونهای خاص است. برخی یونها ممکن است با آنزیمها یا سایر مولکولهای فعال وارد واکنش شوند یا عملکرد آنها را مختل کنند. در چنین مواردی، انتخاب بافری که یونهای مزاحم تولید نکند، از اهمیت بالایی برخوردار است.
علاوه بر این، در آزمایشهایی که نیاز به شرایط استریل دارند—مانند کشت سلولی یا کار با نمونههای زیستی زنده—ضروری است که ترکیبات بافر قابلیت استریلسازی از طریق فیلتراسیون یا اتوکلاو را داشته باشند. همچنین، یونهای همراه موجود در ترکیبات بافر ممکن است با سایر اجزای سیستم واکنش تداخل داشته باشند و موجب بروز خطا یا تغییر نتیجه شوند. به همین دلیل، بررسی سازگاری یونی نیز از دیگر ملاحظات ضروری در طراحی بافر است.
در نهایت، پایداری بافر در برابر تغییرات دمایی نیز باید مدنظر قرار گیرد؛ زیرا برخی بافرها مانند Tris-HCl به شدت تحت تأثیر دما هستند و pH آنها با نوسانات دمایی تغییر میکند.
بهطور مثال، برای واکنشهایی که در pH حدود ۷.۴ انجام میشوند و محیط فیزیولوژیکی دارند، بافر PBS انتخابی ایدهآل محسوب میشود. در مقابل، برای محیطهای نسبتاً بازی با pH بین ۸ تا ۹، بافر Tris-HCl عملکرد بهتری دارد. همچنین در محیطهای اسیدی با pH بین ۳.۶ تا ۵.۶، استفاده از بافر استات توصیه میشود.
تأثیر دما، غلظت و یونهای همراه بر عملکرد بافر
عملکرد یک محلول بافری، صرفاً به pKa و نسبت اسید به باز محدود نمیشود. عوامل دیگری نیز بر توانایی بافر در حفظ pH تأثیرگذارند. از جمله مهمترین این عوامل، میتوان به دما، غلظت کل بافر، و حضور یونهای مزاحم یا یونهای زمینه اشاره کرد.
اثر دما:
دما، بهویژه در برخی بافرها نظیر Tris-HCl، نقش تعیینکنندهای در pH محلول دارد. افزایش دما معمولاً باعث کاهش pH و بالعکس، کاهش دما منجر به افزایش pH میشود. در بافر Tris، بهازای هر ۱۰ درجه تغییر دما، ممکن است تا ۰.۲ تا ۰.۳ واحد pH جابهجایی رخ دهد. بنابراین، در آزمایشهایی که در دمای اتاق انجام میشود، باید pH در همان دما تنظیم گردد.
اثر غلظت:
ظرفیت بافری (Buffer Capacity) که بیانگر توانایی بافر در مقاومت در برابر تغییرات pH است، به غلظت کلی اجزای بافر بستگی دارد. بافری که از ۱ مول اسید و ۱ مول باز مزدوج تشکیل شده، در مقایسه با بافری که از ۰.۱ مول از هر کدام ساخته شده، ظرفیت بسیار بیشتری خواهد داشت. اما غلظت بالا میتواند در واکنشهای حساس زیستی مزاحمت ایجاد کند. پس باید تعادل میان ظرفیت و سازگاری با نمونه برقرار شود.
یونهای همراه:
یونهایی مانند کلرید، سدیم، پتاسیم، یا حتی یونهای فلزی سنگین، ممکن است در عملکرد آنزیمها یا پایداری ساختارهای پروتئینی اختلال ایجاد کنند. از اینرو در انتخاب نوع نمک برای تهیه بافر، باید به سازگاری یونی و احتمال تداخل توجه شود. برای مثال، در محیطهایی که آنزیمهایی با حساسیت خاص حضور دارند، استفاده از بافرهای فاقد یونهای فلزی توصیه میشود.
آموزش گامبهگام تهیه محلولهای بافری رایج در آزمایشگاه
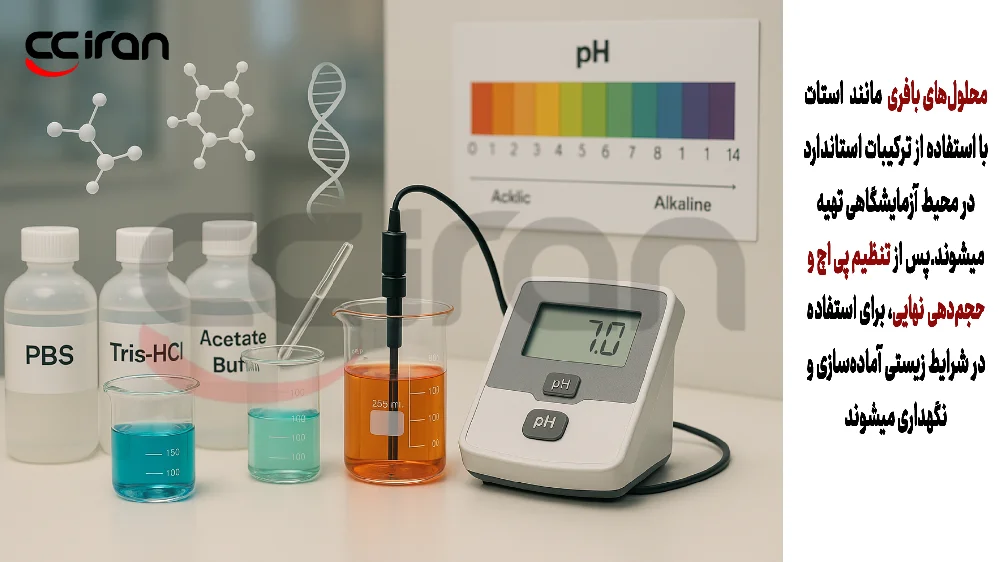
ساخت بافر PBS (Phosphate Buffered Saline)
کاربرد: PBS یکی از پرکاربردترین بافرها در علوم زیستی است. این محلول نهتنها pH را در محدودهی فیزیولوژیک (۷.۲–۷.۴) حفظ میکند، بلکه با ترکیبات نمکی خود، فشار اسمزی محیط را با سلولها هماهنگ میسازد. در کشت سلولی، شستوشوی سلولها، آمادهسازی نمونهها برای PCR، و نگهداری DNA و RNA، PBS نقش کلیدی دارد.
مواد مورد نیاز برای ۱ لیتر PBS 1X:
- سدیم کلرید (NaCl): ۸.۰۰ گرم
- پتاسیم کلرید (KCl): ۰.۲۰ گرم
- دیسدیم هیدروژن فسفات (Na₂HPO₄): ۱.۴۴ گرم
- پتاسیم دیهیدروژن فسفات (KH₂PO₄): ۰.۲۴ گرم
- آب مقطر یا دییونیزه: به مقدار لازم (تا حجم نهایی ۱ لیتر)
- pH متر دیجیتال
- HCl یا NaOH رقیق (برای تنظیم pH)
مراحل تهیه:
۱. کلیه مواد را با ترازوی دیجیتال وزن کنید.
۲. در یک بشر یا ارلن تمیز، ۸۰۰ میلیلیتر آب مقطر بریزید و به ترتیب ترکیبات را در آن حل نمایید.
۳. با استفاده از pH متر کالیبرهشده، pH را اندازهگیری کنید.
۴. در صورت نیاز، با استفاده از HCl یا NaOH رقیق، pH را در بازهی ۷.۲–۷.۴ تنظیم نمایید.
۵. محلول را به بالن حجمی منتقل و با آب مقطر حجم را به ۱ لیتر برسانید.
6. برای کاربردهای زیستی، محلول را با فیلتر ۰.۲۲ میکرون استریل کنید یا به مدت ۱۵ دقیقه در اتوکلاو قرار دهید.
7. ظرف نهایی را برچسبگذاری کرده و تاریخ تهیه، pH، غلظت و نوع بافر را درج کنید.
ساخت بافر Tris-HCl
کاربرد: Tris-HCl بهعنوان یک بافر با خاصیت بازی متوسط، در محدودهی pH ۷ تا ۹ عملکرد مطلوبی دارد. به دلیل تطابق با آنزیمهای رایج و پایداری در استخراج DNA و RNA، در زیستشناسی مولکولی کاربرد گستردهای دارد. همچنین برای تهیه ژل الکتروفورز و بافرهای واکنشی نیز از این محلول استفاده میشود.
ویژگی کلیدی: حساسیت بالای Tris-HCl به دما، اهمیت دمای اندازهگیری pH را دوچندان میکند. معمولاً pH در دمای ۲۵ درجه سانتیگراد تنظیم و ثبت میشود.
مواد لازم برای ۱ لیتر محلول ۱M:
- Tris base (Trizma): ر121.1 گرم
- HCl رقیق: به مقدار لازم برای تنظیم pH
- آب دییونیزه: تا حجم نهایی ۱ لیتر
مراحل تهیه:
۱. Tris را در ۷۰۰–۸۰۰ میلیلیتر آب مقطر حل کرده و هم بزنید تا کاملاً شفاف شود.
۲. با HCl ۱N، بهآرامی و با استفاده از قطرهچکان، pH را به مقدار مورد نظر (مثلاً ۷.۴ یا ۸.۰) برسانید.
۳. محلول را به بالن حجمی منتقل کرده و حجم را به ۱ لیتر برسانید.
۴. محلول نهایی را فیلتر کرده یا در صورت نیاز، استریل نمایید.
۵. اطلاعات کامل را روی ظرف ثبت کرده و در یخچال (۲–۸ درجه سانتیگراد) نگهداری کنید.
ساخت بافر استات
کاربرد: بافر استات برای محیطهایی با pH پایین استفاده میشود. در آنالیزهای کروماتوگرافی، جداسازی پروتئینهای خاص، یا شرایط اسیدی در محیطهای تحقیقاتی، استفاده از این بافر متداول است.
مواد مورد نیاز برای تهیه بافر ۰.۱M با pH = ۴.۵:
- اسید استیک گلاسیال (۹۹٪): ۵.۷ میلیلیتر
- استات سدیم (CH₃COONa): ۸.۲ گرم
- آب مقطر: تا حجم نهایی ۱ لیتر
مراحل تهیه:
۱. ابتدا اسید استیک را به آب مقطر اضافه کرده و سپس استات سدیم را بیفزایید.
۲. محلول را بهخوبی هم بزنید تا هر دو ترکیب حل شوند.
۳. با استفاده از pH متر، مقدار pH را اندازهگیری و در صورت نیاز تنظیم کنید.
۴. حجم را به ۱ لیتر برسانید، محلول را صاف یا استریل کنید و سپس در ظرف مناسب نگهداری نمایید.
خطاهای رایج در تهیه بافرها
در فرآیند تهیه محلولهای بافری، رعایت نکات فنی و اجتناب از خطاهای رایج، نقش اساسی در کیفیت نهایی محلول ایفا میکند. یکی از اشتباهات شایع، استفاده از آب شیر یا آب غیر دییونیزهشده بهجای آب مقطر استاندارد است. این نوع آبها ممکن است حاوی یونها یا ناخالصیهایی باشند که بر pH نهایی تأثیر گذاشته و موجب کاهش دقت و پایداری محلول میشوند. همچنین، عدم کالیبراسیون صحیح pH متر با بافرهای استاندارد پیش از استفاده، میتواند منجر به قرائت نادرست و تنظیم ناصحیح pH گردد. از دیگر خطاهای رایج، افزودن یکباره مواد شیمیایی به محلول است. این اقدام ممکن است موجب واکنش ناگهانی یا جهش pH به خارج از محدوده مطلوب شود. در برخی بافرها مانند Tris، نادیده گرفتن دمای محلول هنگام تنظیم pH باعث میشود که مقدار pH واقعی در دمای مصرف متفاوت از مقدار تنظیمشده باشد. در نهایت، استفاده از ظروف آلوده یا دارای آثار واکنش قبلی نیز میتواند ترکیبات ناخواسته وارد محلول کند و در واکنشهای بعدی ایجاد تداخل نماید. توجه به این نکات، از پیشنیازهای اصلی تهیه یک بافر دقیق و قابل اعتماد در محیط آزمایشگاهی به شمار میرود.
بافرهای جایگزین و تخصصی
بجز بافرهای عمومی مثل PBS، Tris-HCl و استات، بافرهای تخصصیتری نیز برای کاربردهای خاص وجود دارند. در این بخش به برخی از آنها اشاره میکنیم تا مخاطبان حرفهایتر نیز با گزینههای بیشتر آشنا شوند.
بافر HEPES:
یکی از بافرهای بسیار پایدار در pH نزدیک به ۷.۴ است و در کارهای زیستی با حساسیت بالا بسیار مورد استفاده قرار میگیرد. HEPES نسبت به Tris، پایداری دمایی بهتری دارد و در کشت سلولهای پستانداران ترجیح داده میشود.
بافر MOPS:
دارای محدودهی بافری بین ۶.۵ تا ۷.۹ بوده و در مطالعات زیستی مولکولی از جمله استخراج پروتئینهای غشایی، استفاده میشود.
بافر MES:
برای محیطهای اسیدی با pH حدود ۵.۵ تا ۶.۷ مناسب است و در برخی محیطهای کشت باکتریایی کاربرد دارد.
در جدول زیر، مزایا و معایب استفاده از محلولهای بافری آماده که توسط شرکتهای تجاری ارائه میشوند، بهصورت مقایسهای نمایش داده شده است:
|
مزایا |
معایب |
|
صرفهجویی در زمان |
قیمت بالا نسبت به ساخت دستی |
|
حذف نیاز به محاسبه و وزنکشی دقیق |
نیاز به اطمینان از تاریخ انقضا و شرایط نگهداری و حمل |
|
کاهش خطای انسانی در فرمولاسیون |
تنوع محدود در غلظتها و pH |
|
قابلیت استفاده فوری، بدون نیاز به تنظیم |
احتمال ناسازگاری با آنزیمها یا ترکیبات خاص |
|
مناسب برای کاربر مبتدی یا مواقع اضطراری |
عدم کنترل دقیق بر اجزای ترکیب |
|
یکنواختی بالا بین نمونههای مختلف |
بستهبندی گاهی ناسازگار با نیاز آزمایشگاه |
چگونه بافر خوب را از بد تشخیص دهیم؟
پس از تهیه محلول بافری، بررسی عملکرد واقعی آن در شرایط مشابه آزمایش بسیار مهم است. اگرچه محاسبات تئوریک لازماند، اما تضمینکنندهی عملکرد کامل بافر نیستند.
چند راهکار برای بررسی کیفیت بافر:
- پایداری pH در طول زمان: اگر pH بافر طی ۲۴ تا ۴۸ ساعت در یخچال ثابت بماند، نشانهی خوبی از کیفیت آن است.
- پایداری در برابر افزودن قطرهای اسید یا باز: برای ارزیابی ظرفیت بافری، میتوان مقدار کمی HCl یا NaOH (مثلاً ۰.۱ مولار) به محلول افزود و میزان تغییر pH را اندازهگیری کرد.
- عدم تشکیل رسوب یا کدورت: محلولی که بعد از آمادهسازی کدر میشود یا رسوب میدهد، بهاحتمال زیاد دچار آلودگی یا ناسازگاری ترکیبات شده است.
- آزمایش سازگاری زیستی (در صورت استفاده با نمونه زنده): در محیط کشت سلولی، بافر باید از نظر سمیت، فشار اسمزی و رسانایی بررسی شود.
اهمیت برچسبگذاری صحیح و مستندسازی
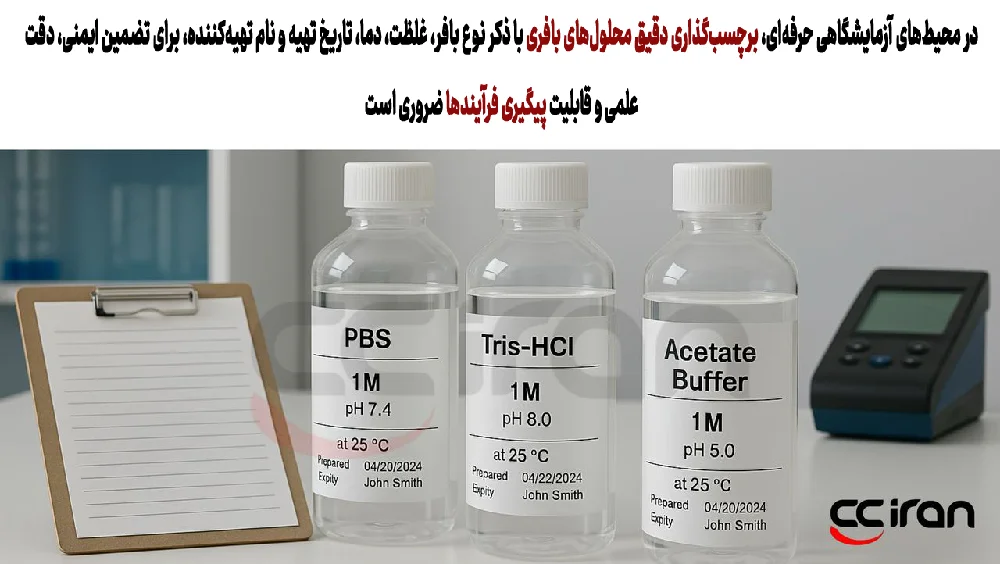
در محیطهای حرفهای و استاندارد آزمایشگاهی، مستندسازی و برچسبگذاری دقیق محلولهای شیمیایی از جمله الزامات کلیدی برای حفظ ایمنی، دقت علمی و قابلیت پیگیری فرآیندها بهشمار میرود. محلولهای بافری نیز از این قاعده مستثنی نیستند. بر روی هر ظرف حاوی محلول بافری، باید اطلاعات دقیق و مشخصی درج شود تا در صورت بروز خطا یا نیاز به بررسی مجدد، امکان ردیابی کامل وجود داشته باشد.
اطلاعاتی که باید بهطور کامل بر روی برچسب محلول درج شود، شامل موارد زیر است:
نوع بافر (مانند PBS، Tris-HCl، استات و...)، غلظت محلول یا مولاریت آن، مقدار دقیق pH تنظیمشده، دمایی که pH در آن تنظیم شده است (بهویژه برای بافرهای حساس به دما مانند Tris)، تاریخ تهیه و در صورت امکان، تاریخ انقضا یا مدت زمان توصیهشده برای استفاده، و نهایتاً نام شخص یا مسئول آزمایشگاه که محلول را تهیه کرده است.
رعایت این موارد نهتنها از بروز خطاهای انسانی یا استفاده نادرست جلوگیری میکند، بلکه در سیستمهای کنترل کیفیت، ایمنی آزمایشگاهی، و گزارشدهی نتایج نیز نقش کلیدی دارد.
جمعبندی نهایی
تهیه محلول بافری، اگرچه در ظاهر ساده به نظر میرسد، اما نیازمند دقت، درک عمیق از اصول شیمی، و رعایت کامل نکات عملی است. در این مقاله تلاش شد تا ضمن معرفی اصول بنیادی بافر، کاربردهای مختلف آن بررسی گردد و با ارائه آموزش عملی، راهنمایی دقیق برای تهیه سه بافر پرکاربرد در آزمایشگاه فراهم شود.
همچنین با پرداختن به عوامل مؤثر بر عملکرد بافر، خطاهای رایج، گزینههای تخصصی، بررسی کیفیت و برچسبگذاری علمی، این راهنما به سطح بالاتری از جامعیت و کاربرد ارتقا یافت.
در نهایت، توانایی ساخت و کنترل بافر یکی از مهارتهای بنیادی برای هر دانشجو، تکنسین، یا پژوهشگر در حوزه علوم پایه و زیستی است که بهطور مستقیم بر کیفیت نتایج علمی و موفقیت آزمایش تأثیر خواهد گذاشت.